子宫是人类生殖的重要器官;其内层组织,即子宫内膜,是一种高度动态的组织,经历生长(增殖期)、分化(分泌期)、退化(月经期)和再生等周期性阶段,以响应卵巢激素变化。子宫内膜的重塑和再生过程中的异常可能导致不孕、反复流产、子宫内膜肿瘤、炎症、薄子宫内膜和子宫内膜异位症等问题。子宫内膜功能障碍影响着许多育龄妇女。某些缺陷会影响排卵后分泌期的子宫内膜感受性,可能导致不孕。然而,着床窗口的调控以及着床的机制仍然不明确。此外,由动物模型得出的结果由于激素调节和人类母胎界面的复杂性差异,难以轻松地转化为人类背景。由于缺乏可靠和具有代表性的模型,理解人类子宫内膜功能面临着很大的障碍。
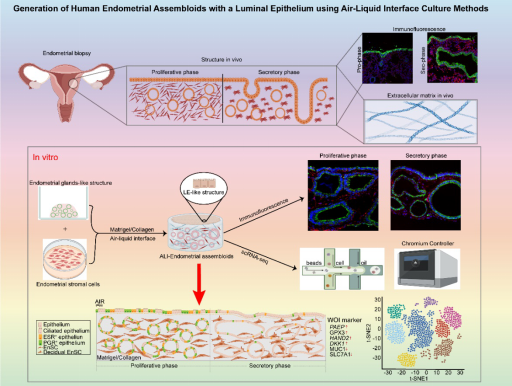
2023年8月27日,省部共建非人灵长类生物医学国家重点实验室/昆明理工大学灵长类转化医学研究院李天晴教授和云南省第一人民医院马艳萍主任合作,在Advanced science期刊发表题为Generation of Human Endometrial Assembloids with a Luminal Epithelium using Air-Liquid Interface Culture Methods的文章。该研究通过结合子宫内膜上皮细胞(EnECs)和基质细胞(EnSCs),并采用改进的基质胶和气液界面(ALI)培养方法,首次构建了一种新型EnAo模型- ALI-EnAo(子宫内膜-腔上皮复合体)。ALI-EnAos展示了完整的EnSCs和腺体上皮以及腔面上皮,重现了人类子宫内膜的解剖学结构、细胞组成、激素诱导的月经周期变化、基因表达谱以及动态纤毛发生。

在这项研究中,我们使用一种以前报道过的方法,从人子宫内膜组织活检中生成腺体样结构(GLSs)。然后我们确认了它们的长期传代能力、克隆能力、上皮特征和激素反应性(图S1a-i)。腺体样结构显示出与以前报告相似的特征。我们通过消化子宫内膜活检来纯化EnSCs,然后在2D单层培养中繁殖细胞。然后我们确认了它们的身份和蜕膜化潜能(图S1j-p)。
接下来,我们结合EnSCs和EnECs,并研究EnSCs如何影响上皮结构。为了优化培养,我们评估了不同的EnEC:EnSC组装比例及其对GLS形成和生长的影响(图S2a,b)。经过一系列的检验,我们发现EnEC:EnSC比例为1:3最有利于GLS的生长(图S2b)。GLS由紧密排列的上皮细胞组成的柱状结构组成,与体内子宫内膜中发现的柱状细胞相似,此外还有由鳞状上皮组成的鳞状细胞结构(图S2c) 。EnSCs的存在影响了GLS的形态,并显著促进了GLS中柱状上皮细胞的形成(图S2c)。根据这些数据,除非另有说明,否则我们将所有后续实验的装配比设置为1:3。我们将EnSCs和EnECs的集合命名为“子宫内膜-腔上皮复合体”(EnAo)。
我们评估了组装体内的细胞行为是否与体内相应细胞的行为相似,并探索了添加EnSCs方面后GLS的任何变化,这些变化之前尚未在复合体中阐明。为此,我们检测了细胞对激素刺激的反应性,并分析了它们的基因表达谱。我们通过分别使用雌二醇(E2)或雌二醇(E2)、孕酮(P4)和环磷酸腺苷(cAMP)的组合处理EnAos,分别进行了八天和四天的处理模拟其体内月经周期(图S1d)。EnAos中E2处理的EnEC与缺乏EnSCs的GLS中表现出相似的增殖能力(图1a,b)。经E2、P4和cAMP处理后,EnAos中EnEC的生长几乎完全被抑制,这与EnAos体内的表型一致(图1b、c)。相比之下,我们观察到EnECs在缺乏EnSCs的GLS中增殖更高(≈8%),这与之前报道的结果一致(图1b,c)。因此,我们的结果表明,EnAos细胞增殖能力对激素的反应更符合体内情况。
子宫内膜细胞的另一个激素依赖性特征是调节运动纤毛在上皮系统中起着多种作用。例如,在人类的呼吸系统和生殖系统中,它们以协调的方式跳动,促进液体流动,参与粘液清除,并使配子和胚胎运输。体内腺体和腔内纤毛细胞的比例在整个月经周期中都是不同的。雌激素促进纤毛细胞的生长,而黄体酮拮抗雌激素的作用,导致纤毛细胞直到妊娠期的解调;这增强了胚胎的贴壁、粘附和对子宫内膜的侵袭。与体内纤毛细胞的变化相似,我们发现,在前期,约5%的EnAo细胞表达乙酰化-α-tubulin+ -纤毛细胞的标志。纤毛细胞的比例在第二阶段下降到检测不到的水平(图1a,c,d)。相比之下,缺乏EnSCs的GLS在整个月经周期中含有纤毛细胞,25-30%的细胞表达乙酰化-α-tubulin+(图1a,c,d),与之前的结果一致。这些结果表明,EnSCs诱导纤毛细胞数量减少,是维持整个月经周期纤毛细胞动力学所必需的(图1a,c,d)。此外,在体内和EnAos的纤毛形态在第二阶段都变得更短、更平(图1a、c);然而,这些变化在缺乏EnSCs的GLS中并不明显(图1a,c)。
为了进一步评估缺乏EnSCs的腺体状结构(GLSs)与经过蜕膜化的EnAos之间的差异我们使用10x Genomics平台进行了scRNA-seq分析。基于典型的细胞标记,使用 UMAP分析的细胞类型注释确定了三个主要群体:纤毛上皮、纤毛上皮和基质群体(图S2d,e)。整合分析显示,缺乏EnSCs的GLS和EnAos的纤毛上皮细胞(UECs)的基因表达和细胞亚群之间存在显著差异,特别是与炎症反应和细胞外基质相关的基因(图1e;图S2f)。与缺乏EnSCs的GLSs相比,EnAos的UECs中有460个基因表达显著上调,916个基因表达下调(图1f;图S2g)。EnAo-UECs中上调的基因与正向调控细胞粘附、上皮细胞迁移、血管生成和蜕膜化相关,这些都是第二阶段子宫内膜适应胚胎着植的功能(图S2h)。值得注意的是,一些对子宫内膜容受性重要的基因也上调,包括SPP1、ITGB1、HES1和VEGFA(图1g)。这些下调的基因与炎症反应相关,与母胎免疫脱乳耐受过程中大量趋化因子和其他炎症调节因子持续下调一致。这些发现表明EnAos中的基因表达模式反映了植入体内。
最后,我们检查了纤毛细胞的特征。EnAos纤毛细胞中的差异表达基因(DEGs)与缺乏EnSCs的GLS相比,包括1288个下调的与纤毛组织、微管运动和纤毛组装相关的基因,包括DNAAF3、RFX3和PIFO(图1f,h;图S2g,i)然后,我们使用Cell Chat来探究EnAos亚种群之间的假定交互作用。在包括WNT、EGF和IGF在内的几个显著富集的信号通路中,配体受体的相互作用以EnSC-EnEC和EnEC-EnSC为中心(图1i),这显示了EnEC和EnSCs之间的相互作用。这些结果表明EnSCs在整个月经周期中对维持动态的激素反应性纤毛发生至关重要,并提示更准确的体内子宫内膜上皮动力学表征。此外,这些结果表明,加入EnSCs可改善EnEC的表型和基因表达模式。
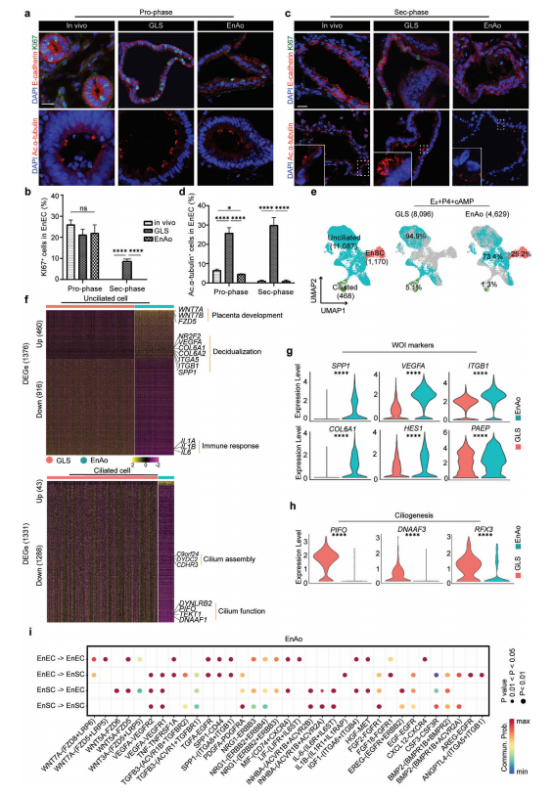
图1.子宫内膜基质细胞(EnSC)有助于腺样上皮细胞的活性
接下来我们研究了外基质对细胞形态和增殖的影响。当EnSCs嵌入到不同的ECM中时,EnSCs表现出不同的形态,在MAC和COLI基质中显示成纤维细胞样的形态,在基质胶l中显示收缩或不规则的形态(图2c)。迁移是EnSCs的一个重要功能。许多EnSCs从MAC和COLI边缘迁移,但没有从基质胶l边缘迁移(图2c)。定量显示,在基质胶l和MAC中GLS的增殖水平相当,高于COLI(图2d,g)。然而,增殖型EnSCs仅在COLI(3%)或MAC(5.6%)中观察到(图2f,g)。有趣的是,大多数增殖性EnSCs位于GLS附近(图2f),提示EnSCs的增殖可能是由GLS旁分泌信号诱导的这些结果表明,MAC是EnAos培养过程中与生理相关的ECM条件。
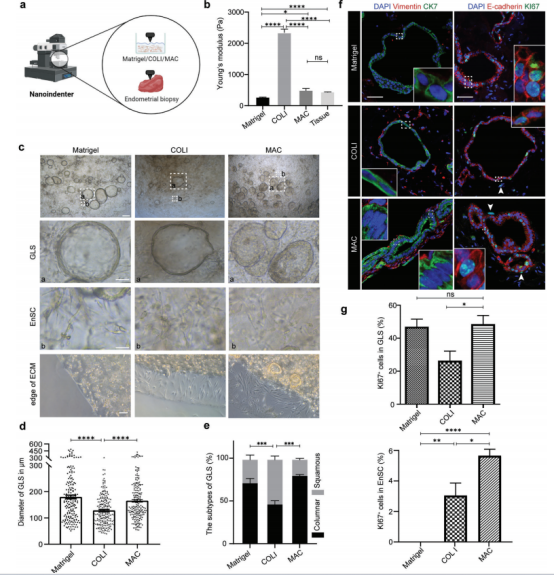
图2.基质胶和胶原蛋白的组合促进生理性EnAo形成
我们下一步的目标是进一步完善我们的培养条件,以促进功能性的、激素反应的管腔上皮样结构(LELSs)和GLSs的形成。LE和表层GE随月经周期连续丢失和重建,是胚胎着床过程中子宫内膜的重要功能单位。为了使EnAos能够形成功能性的LEls和GLS,我们使用气液表面(ALI)培养系统对EnAo培养细胞复制腔内子宫内膜黏液层覆盖的上皮结构的体内环境(图3a,b)。我们将这种培养系统命名为ALI-EnAo,以区别于传统液体培养基中生长的EnAos (SC-EnAo)。
为了探究激素如何影响ALI和SC生长的细胞的形态、连接和受体基因表达,我们在第4天(D4)和第15天(D15)检测了E2处理的增殖性ALI- EnAos和SC-EnAos,分别代表增殖性子宫内膜的早期和晚期阶段(图3b)。与SC-EnAos培养相比,ALI-EnAos培养显著促进GLS扩增 (图S3a,b)。然后根据形态学和免疫染色结果,我们将GLS分为三种亚型(图S3c)。当我们将前期(D15) SC-EnAo培养物与ALI-EnAo培养物进行比较时,我们发现ALI-EnAos强烈促进I型GLS的形成,这是一种由柱状上皮覆盖的囊状结构(图3c;图S3a,d)。在体内,柱状LE细胞形成紧密连接,呈现闭塞小带-1的极化分布(ZO-1)(图3c)。同样,ALI-EnAos培养条件促进EnAos形成一个zo -1偏振分布在D4或D15上的LELS(图3c,d;图S3e)。相反,SC条件下,表面细胞排列成简单的鳞状上皮(SSE),即使在扩大培养后也缺乏紧密连接,表明缺乏典型的LE结构(图3c,d;图S3e)。此外,SC培养的EnEC细胞增殖弱,几乎没有KI67+染色,而ALI培养的LEls EnEC细胞增殖强,在D4或D15上KI67+阳性表达,与体内上皮细胞相似(图3c,e)。我们也评估了ALI培养对纤毛形成的影响。ALI培养的GLSs (ALI-GLSs)产生纤毛细胞,从D4开始数量增加;这些结果与在体内的GEs相似,并且明显高于SC-GLSs的结果(图3f,g;图S3e,f)。此外,ALI-LELS在D15上产生纤毛细胞,与体内增殖的LE相当,而SC-SSE没有检测到纤毛细胞(图3f,g;图S3e,f)。这些结果表明,ALI条件促进EnEC的纤毛发生,特别是在LEls中。最后,与体内的表达模式相似(图3h),在E2处理的ALI-EnAos中,前期LELSs和GLSs均表达ESR和PGR,但不表达一种分泌特异性标记物——孕激素相关子宫内膜蛋白(PAEP)(图3i;图S3g)。ESR和PGR也在经E2处理的SC-EnAos的GLS中表达,但在SC-SSE中不表达(图S3h)。
为了进一步探究ALI培养条件对EnAos的影响,我们先用E2处理4天,然后用P4和cAMP处理4天;然后我们用ALI或SC条件对组装体进行培养,再培养4天或15天,以模拟分泌性子宫内膜(图4a)。我们发现ALI培养方法对GLS展开有显著的正向影响(图S4a,b)。在SC条件下,我们观察到更多的带有细胞碎片的异常II型GLS和较少的以折叠和弯曲为代表表型的III型GLS在sec期(图S4c)。ALI培养的LEls主要由柱状或立方细胞组成,与体内子宫内膜LE相似(图4b;)。在ALI长期培养后,柱状上皮细胞的比例显著增加(图4c)然而,几乎所有的SC培养的表层上皮细胞都保持扁平的细胞核和无紧密连接的鳞状排列(图4 b、c;图S4 d),表明典型的LELS层未能形成。由于P4可以拮抗E2处理诱导的细胞分裂和纤毛发生,几乎所有的GE细胞在体内都失去了它们的增殖能力,但是0.4 -7%的ALI-LELS仍然对KI 67呈阳性,这与体内表型一致(图4 b,d)。此外,分泌型EnEC产生的纤毛细胞比增殖型EnEC少来自体内、ALI-EnAos和SC-EnAos组的GLS或GE细胞是相似的,并且产生一些具有短纤毛的纤毛细胞(图4 e、f;图S4 d-f)。在D15的ALILELS中,我们检测到约7%的纤毛细胞,其接近于用体内LE观察到的约8%,但在SCSSE中未检测到纤毛发生(图4 e、f;图S4 d,e)。我们接下来通过用P4和cAMP处理培养物来检测蜕膜化后的基因表达模式。我们观察到ESR和PGR的降低以及LELS和GLS中PAEP的积累,这进一步证实了蜕膜化ALI-EnAos(D4和D15)重现分泌期子宫内膜(图4g;图S4 g)子宫上皮中PGR表达的下调是哺乳动物着床的常见要求,因为它使子宫内膜容受性(图4g;图S4 g-i)。尽管我们观察到二期SC-EnAos的GLS中三种标记物的类似结果,但不存在典型的LELS结构 。
总之,这些结果表明,使用ALI培养方法在MAC 基质上生长的EnEC和EnSCs结合产生了一个包含LELS和GLS的子宫内膜组合体,这准确地再现了体内子宫内膜的细胞组成、解剖和月经周期特征。

图3.气液界面培养方法改善了前期的EnAo特征
我们对结构和标记基因的分析结果表明,ALI-EnAos再现了体内子宫内膜。为了确定这种相似性是否扩展到分子水平,我们利用单细胞RNA-seq (scRNA-Seq)对ALI-EnAos在前期和后期进行了转录组分析。我们使用经E2处理8天的ALI-EnAos来表示增生性子宫内膜(ALI-EnAos在前期D4)(图3b)。然后我们使用P4和cAMP处理的ALI-EnAos 8天来代表分泌期(在D4上的ALI-EnAos在sec期)(图4a);这可能相当于体内黄体生成素激增后6-9天的中期分泌子宫内膜。我们将ALI-EnAos分离到单细胞,并使用10x Genomics平台进行scRNA-seq。经过质量控制和过滤,获得了人ALI-EnAos的前期和二期的单细胞转录组。我们还整合了来自整个体内增殖和分泌子宫内膜的10x基因组数据作为参考整合到ALI-EnAos(图S6a)。然后,我们将ALI-EnAos与去除免疫细胞、内皮细胞和平滑肌细胞的体内子宫内膜进行对比分析(图5a)。我们的综合分析根据基因表达模式确定了三种主要的细胞类型(图S6b),所有这些细胞在ALI-EnAo和体内子宫内膜中都清楚地表现出来(图5a;图S6a)。
为了更好地了解细胞亚群在ALI-EnAos和体内子宫内膜,我们亚聚了三种主要细胞类型,并进行了进一步的表征。根据基因标记表达和GO分类,EnSCs可分为6个亚型;所有这些在ALI-EnAo和体内子宫内膜中都有清晰的表现(图5b,c;图S6c)。优势EnSC亚群(EsS1)表达细胞外基质和胶原纤维组织标记基因,包括SPARC、COL3A1和COL5A2(图5c;图S6c)。推测表达CXCL8、CXCL1和IL6基因的EsS2亚群主要发挥免疫调节功能(图5c;图S6c),与经期、修复期、孕期EnSCs的免疫耐受及与免疫细胞的相互作用一致EsS3亚群表达ITGB8和PTGS2基因,并富集TGF-β的产生和顶外侧质膜相关基因的表达(图5c;图S6c)。EsS4亚群特有的基因,包括FOS、FOSB、JUN和ZFP36,与氧化应激反应、造血调节和细胞对EGF的反应有关,表明EsS4亚群是高度分化的,可能在组织修复和再生中发挥作用(图5c;图S6c)。值得注意的是,EsS5亚群的转录组谱显示了胚胎着床和细胞衰老相关基因的富集(图S6c),这表明该亚群可能参与了胚胎着床。EsS6是一个增殖亚群,表达细胞周期基因(图5c;图S6c)。因此,ALI-EnAos重演了具有多种功能的EnSC亚群。
为了进一步确定子宫内膜细胞的组成,我们还分析了纤毛细胞。这些细胞被亚聚成5个亚群(EcS1-5)(图5d)。GO分析表明,EcS1亚群参与上皮细胞的发育和增殖;纤毛组装、细胞运动和微管运动中的EcS2亚群;EcS5亚群代表活跃分裂的纤毛细胞,这些纤毛细胞只存在于前期纤毛细胞中(图5e;图S6d)。我们在人子宫内膜观察到的两个簇(EcS3和EcS4)在ALI-EnAos中没有出现(图5d)。两个缺失的簇分别与蛋白质合成和细胞应激相关(图5e)。拟时分析显示,这两个亚群大部分属于成熟细胞(图5f)。它们在ALI- Enenaos中的缺失可能反映了与ALI一起培养的时间较短,导致分化不完全。我们还发现EcS3和EcS4的基因和唯一分子标识(UMIs)明显低于其他亚群,提示这两个亚群可能受到了单细胞制备或RNA-Seq技术噪声的影响(图S6e)。与整个月经期体内纤毛细胞趋势一致,P4和cAMP处理的ALI-EnAos中纤毛细胞的最高代表出现在伪时间分析的较晚时间点(图S6f)。
为了完成细胞分析,我们检查了上皮纤毛细胞(EucS)。亚聚类显示ALI-EnAo的EucS与体内子宫内膜的EucS具有高度的相似性(图5g)。纤毛间室含有分化的上皮细胞(EucS1),参与上皮细胞增殖、受体配体活性和胚胎植入(图5h),并表达了包括MUC1和IL6在内的受体调节基因(图5i)。EucS2可能代表了分泌专一的亚群,因为它特异性表达两个分泌珠蛋白家族基因(SCGB2A1和SCGB1D2)[25],并富含高尔基相关囊泡膜和内源性囊泡(图5h,i)。EucS3亚群中的基因与上皮细胞迁移、发育、形态发生和上皮-间充质转化(EMT)相关(图5h)。值得注意的是,NEAT1和KCNQ1OT1基因与EMT相关(图5i).ALI-EnAos中的纤毛细胞也包括一个活跃分裂的EucS4亚群(图5i)。最后的亚群EucS5表达典型子宫内膜容受性基因(ADRA2A、CLDN4、ARG2和PAEP),这些基因是WOI的指标(图5i)、以及与过氧化物酶和MAPK磷酸酶活性相关的基因(图5h)。这两种关键酶的激活与黄体酮诱导的衰老相关分泌表型(SASP)有关。这表明该亚群参与了生理组织重塑、胚胎发育和胎盘形成SASP的典型标记物DPP4 (二肽基肽酶4)、在EucS3和EucS5亚群中表达(图5h),表明EucS3可能参与了植入。
总之,我们的RNA-seq分析不仅表明,ALI-EnAo在细胞组成和基因表达方面与体内子宫内膜相似,而且它还构成了子宫内膜细胞群及其相应转录组的图谱。
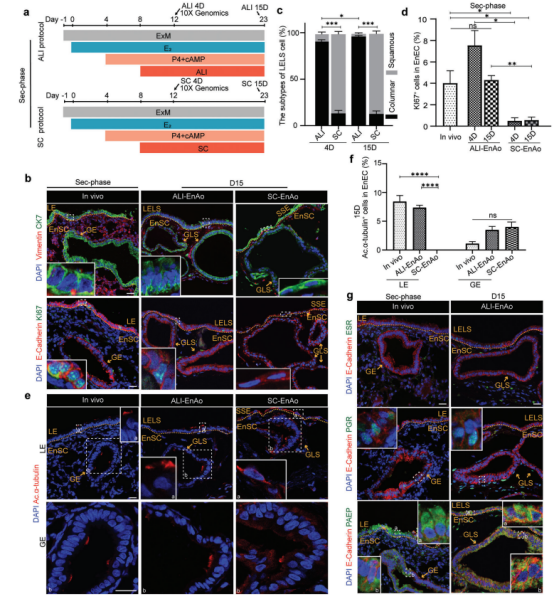
图4.气液界面培养方法改善了第二阶段的EnAo特征
在体内的纤毛上皮中,腔上皮细胞和腺上皮细胞在整个月经周期中呈垂直分离为了证实LE和GE在ALI-EnAos的纤毛上皮中存在,我们整合了来自ALI-EnAos的纤毛上皮和体内子宫内膜的数据,然后根据之前报道的基于其体内转录组和染色的定义对体内LE/GE群体进行标记(图6a)然后,我们根据基因表达模式和典型LE和GE标记对ALI-EnAos的腔管和腺上皮群体的纤毛上皮进行了注释(图6a,b;见实验部分;图S6g)。WNT7A基因在灵长类[39]和人类[19,25,40]管腔上皮中高度表达,主要在假定的LE亚群中表达(图6a,b)。其他LE标记物,包括VTCN1和MSLN,也在假定的LE亚群中特殊表达(图6a,b)。相反,HEY1、SCGB2A2和FOXA2在假定的GE亚群中高表达(图6a,b)。LE-和GE -特异性标记物的表达模式相似(图6a,b),提示LE-和GE -样亚群在ALI-EnAos中的分布与体内子宫内膜的分布一致,如既往报道所定义值得注意的是,我们在ALI-EnAos和体内子宫内膜之间观察到LE分布有一些明显的差异(图6a,b)。这可能是因为体内样本跨越了月经周期的五个不同阶段(增殖期、早期、早期中期、中期和晚期分泌期),而EnAos仅包括两个阶段。因此,我们将LE/GE亚种群描述为类LE/类GE亚种群。此外,在ALI-EnAos和体内子宫内膜中定义的LE和GE略有混合,这可能是由于EucS1-5亚群的差异,而不是LE和GE。ALI-EnAos的EucS1和EucS5主要分布在类LE亚群中,而EucS2-4主要分布在类GE亚群中,与它们在体内的分布相似(图6c)。
GO分析表明,ALI-EnAos中LE样亚群中富集的基因与上皮细胞迁移、受体介导的内吞作用、胚胎着床以及LE的发育和分化高度相关,包括与分支结构的形态发生相关的基因。和分化调节(图6d);这些结果与体内LE功能一致我们还观察到在LE样亚群中正的典型WNT信号通路调控(图6d)在ALI-EnAos GE-like亚群中富集的基因与蛋白质合成和分泌相关,这是典型的GE功能(图6d)。为了进一步鉴别LELS,我们用LE标记物进行了免疫染色。COX1和KRT5在Pro-或Sec-phase ALI-EnAos的LELS中均有明显分布(图6e),与体内LE表达模式相似此外,MUC1染色显示ALI-EnAos LE细胞可以产生粘液(图6f)。总的来说,我们的结果表明,ALI-EnAos形成典型的LEls和GLS,类似于体内子宫内膜上皮。

图5. ALI-EnAos具有与体内子宫内膜相似的转录组
为了说明ALI-EnAos比SC-EnAos更接近体内子宫内膜,我们比较了E2和E2+P4+cAMP处理后的单细胞转录组。该分析显示了三种主要细胞类型的分布差异:EnSCs、纤毛细胞和纤毛细胞(图7a;图S7a)。
然后我们在SC-EnAos和ALI-EnAos之间的三种细胞类型中鉴定出DEGs。在ALI培养的EnSCs中,有662个基因显著上调,800个基因下调(图7b)。上调的基因包括FGF7、PDGFRA、CRISPLD2和WNT5A(图7b),与非典型WNT信号通路、女性怀孕和对类固醇激素的反应相关(图S7b)。催乳素(PRL)和胰岛素样生长因子结合蛋白1 (IGFBP-1)是去脂化EnSCs的重要标志物。FOXO1和HAND2这两个主要因素也对EnSC蜕壳化至关重要。脱脂EnSCs通过分泌DKK1抑制WNT通路来调节分泌性内皮细胞[8,43]与SCEnSCs相比,ALI-EnSCs中除HAND2外,上述四种基因的表达均显著增加(p < 0.05)(图7c;图S7c)。
根据免疫染色结果,纤毛细胞构成了另一个关键的差异亚群(图7a)。由于纤毛的发生主要是由E2诱导的,纤毛的功能与运动有关,我们在前阶段专门检测了纤毛运动和纤毛发生相关的基因。有趣的是,与SC-EnAos相比,与内动力蛋白臂、径向辐和动力蛋白组装相关的基因在ALI- enaos中特异性表达(p < 0.05)(图7d),表明ALI可能通过调控纤毛结构蛋白和调控蛋白促进纤毛发生。
无纤毛上皮也表现出显着差异。我们观察到839个基因在ALI培养的无纤毛上皮中表达上调,这些基因与组织极性的建立、极化上皮的形态发生、WNT信号通路和胚胎着床有关(Figure S7d,e)。WNT信号活性与子宫内膜LE的形成密切相关。上调的基因与这些生物学过程相关,包括ALI-EnAos中极性LE的形成。ALI-EnAos中有852个下调的基因,主要与糖酵解过程和血管发生相关。
子宫内膜的一个重要特征是对激素波动的反应。由于UECs的基因表达在整个月经期发生变化,我们分析了E2和E2+P4+cAMP处理后ALI-UECs和SC-UECs之间的DEGs(图7e)。在E2处理的ALI-UECs中,上调的基因包括WFDC2和LIF,主要与LE标记物相关,下调的基因包括与细胞凋亡相关的FOS和JUNB,以及与高氧浓度相关的VEGFA(图7e)。E2+P4+ cAMP处理的ALI-UECs中,上调的基因包括SCGB2A、SCGB1D2和PAEP(编码分泌蛋白)、EMT标记物NR2F2和VIM(图7e)这表明ALI培养促进了UECs分泌功能的改善。
分泌性子宫内膜的一个重要功能是为子宫胚胎着床做准备。子宫内膜容受性阵列(ERA)在临床上用于帮助识别WOI开口。我们比较了E2+P4+cAMP处理后代表性ERA基因的表达模式,发现ALI-EnAos更接近于定义的WOI开口(图S7f)。值得注意的是,在ALI-EnAos中,胚胎植入需要上调的WOI基因SPP1、GPX3、DEFB1和arg2 均显著上调。相反,通常在分泌中期下降的基因,如BIRC1、SERPINA5、CRABP2和ECM1 在ALI-EnAos中显著下降(图7f)。这些数据表明,ALI-EnAos可能为研究人胚胎着床机制提供了一个较好的模型。WNT信号通路对LEinvivo,的形成很重要,我们注意到在ALI-EnAo上皮细胞中,非典型和典型WNT信号通路相关基因显著上调(图7g;图S7e)。
总之,我们的数据表明,ALI培养通过上调与EnAos细胞极性、纤毛发生、蜕膜化、分泌、WNT信号和WOI相关的基因,改善了EnAos细胞的组成、解剖结构和基因表达模式。

图6. ALI-EnAos中管腔上皮和腺上皮的鉴定
总之,该研究建立了一个具有完整腔上皮(LE)和腺上皮 (GE)结构的子宫内膜复合体模型。通过将子宫内膜基质细胞(EnSCs)与来自患者的类器官结合,这一创新模型可能能够对导致不孕和妊娠失败的不同子宫内膜疾病进行建模,并可能促进辅助生殖技术个性化和精确的处理计划的制定。此外,该模型对于研究复杂的人类母胎关系也具有重要的价值。
原文链接:https://doi.org/10.1002/advs.202301868
模基生物子宫内膜癌类器官培养基套装是一种化学定义的细胞培养基,子宫内膜癌类器官试剂盒是一种化学定义的细胞培养基,用于建立和维持人类子宫内膜癌类器官。